Contexte scientifique
Le low density lipoprotein (LDL) receptor-related protein (LRP) appartient à la famille du gène du récepteur LDL. Il participe ainsi à l’endocytose des lipoprotéines riches en ApoE. Il a été montré que le LRP peut également être impliqué dans le contrôle de processus de signalisation intracellulaire. Des souris déficientes en LRP-1 spécifiquement au niveau des CMLVs ont une susceptibilité accrue à développer des lésions athéroscléreuses. Ces lésions se caractérisent notamment par une hyperprolifération des cellules musculaires lisses (CMLV) avec activation de la voie de signalisation du facteur de croissance PDGF (Platelet Derived Growth Factor) et augmentation de l’expression de Phospho-Erk, un activateur de la prolifération cellulaire [1]. Par ailleurs, le récepteur au PDGF et le LRP sont capables de fonctionner au sein d’un complexe, l’activation du récepteur au PDGF conduisant à la phosphorylation en tyrosine du deuxième motif NPxY localisé au niveau du domaine cytoplasmique du LRP [2].
Ces résultats montrent que le LRP contrôle la prolifération cellulaire et la voie du PDGF et protège contre l’athérosclérose. Il reste maintenant à déterminer comment le LRP exerce ce contrôle.
La formation des lésions athéroscléreuses est caractérisée par la création d’un environnement à haut potentiel mitogène, riche en facteurs de croissance tels que le PDGF BB, l’IGF-1 ( Insulin-like growth factor). La liaison de ces facteurs à leurs récepteurs permet la phosphorylation de ces derniers et le recrutement de protéines de signalisation conduisant à l’activation de la cascade des MAPK. Ceci aboutit à la phosphorylation de ERK et à la prolifération cellulaire.
ShcA (Src homology and collagen) est une protéine adaptatrice, existant sous trois isoformes (p66, p52 et p46) capable de relayer l’activation de ces récepteurs à la cascade des MAPK. ShcA peut se lier au niveau des résidus phosphorylés de la partie cytoplasmique des récepteurs activés. L’association de Shc avec un récepteur est un pré-requis pour la phosphorylation et l’activation de Shc qui sert ainsi de point d’ancrage pour le recrutement de molécules de signalisation. A l’heure actuelle, la cascade Shc :Grb2 :Sos :Ras qui conduit finalement à la phosphorylation de ERK et à la prolifération cellulaire représente la voie de signalisation la mieux connue en aval de ShcA [3].
Il a été montré par ailleurs que ShcA était capable de se lier au LRP phosphorylé sur sa partie cytoplasmique [4].Le rôle de cette interaction physique entre ShcA et LRP dans la prolifération cellulaire et la formation de lésions athéroscléreuses est encore inconnu.
L’ objectif de ce projet est de déterminer si la signalisation ShcA-LRP contrôle la prolifération cellulaire et d’identifier in vitro et in vivo par quels mécanismes le complexe LRP-ShcA effectue cette régulation.
Objectifs
Objectif 1 : Caractériser in vitro le rôle du LRP sur l’activation de ShcA
Objectif 2 : Caractériser in vivo l’importance de ShcA dans le développement des lésions athéroscléreuses chez la souris (souris déficientes en ShcA dans les CMLV ou souris déficientes en ShcA dans les cellules endothéliales).
Résultats
Objectif 1 : Approche in vitro
La présence du LRP est elle nécessaire pour l’activation de ShcA ?
Pour répondre à cette question nous disposons de fibroblastes embryonnaires de souris en lignée exprimant le LRP (MEF LRP+/+) ou déficientes en LRP (MEF LRP -/-).
Nos résultats préliminaires (obtenus par fractionnement cellulaire) montrent un recrutement de ShcA à la membrane dans les MEF LRP +/+, après stimulation des cellules par l’insuline, un facteur de croissance utilisant des voies de signalisation intracellulaire communes à celles de l’IGF-1 (figure 1). En revanche, dans les cellules déficientes en LRP, ShcA est déjà présent au niveau membranaire à l’état basal et passe dans le compartiment cytosolique après stimulation à l’insuline (figure 1).
Le LRP influence donc le trafic intracellulaire de ShcA après stimulation à l’insuline.
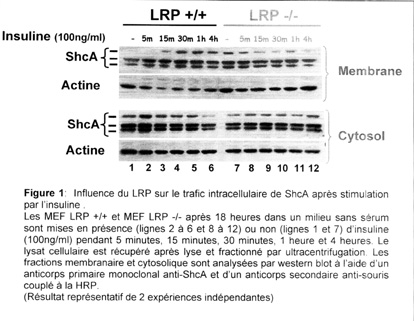
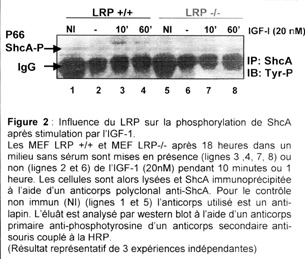
Puisque la phosphorylation de ShcA est nécessaire au recrutement de Grb2 et à l’activation des MAPK en aval, nous avons également étudié l’état de phosphorylation de ShcA en tyrosine. Les résultats préliminaires montrent une phosphorylation de j’isoforme p66 de ShcA dans les MEF LRP+/+ qui est augmentée après 10 minutes de stimulation par l’IGF-1(20nM). Cette phosphorylation n’est pas présente dans les MEF LRP -/- (figure 2). L’état de phosphorylation des isoformes p52 et p46 n’est pas interprétable car leur migration est masquée par les immunoglobulines.
Le LRP serait donc nécessaire à la phosphorylation de l’isoforme p66sn`A après stimulation par l’IGF1.
La présence du LRP a-t-elle une influence sur l’activation des protéines partenaires de ShcA et impliquées dans la cascade de prolifération ?
Pour répondre à cette question nous avons suivi l’état d’activation des éléments impliqués dans la cascade ShcA : Grb2 : Sos : Ras : Erk, en aval de ShcA, après stimulation par l’IGF-1 dans les MEF LRP-/- et LRP +/+.
L’analyse (par Western-blot) de l’expression de Grb2 montre une augmentation de son expression après stimulation par l’IGF-1 avec un maximum à 30 minutes dans les MEF LRP +/+. Dans les MEF LRP-/-, une cinétique similaire est retrouvée, mais quantitativement l’expression de Grb2 est nettement diminuée (figure 3).

L’analyse (par Western-blot) de l’expression de phospho-Erk montre une augmentation de son expression après stimulation par l’IGF-1 avec un maximum entre 5 et 30 minutes dans les MEF LRP+/+. Dans les MEF LRP -/- une cinétique similaire est retrouvée mais quantitativement l’expression de phospho-Erk est nettement diminuée (figure4).
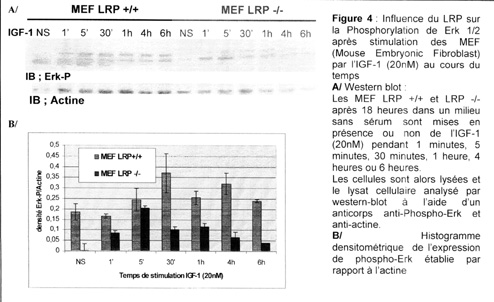
Le LRP participe donc à l’activation des protéines partenaires de ShcA impliquées dans la cascade de prolifération après stimulation par l’IGF-1.
Le LRP, ShcA et le récepteur à l’IGF font-ils partie d’un même complexe de signalisation ?
Afin de comprendre comment le LRP contrôle la cascade ShcA-Grb2-Erk1/2, nous cherchons quels sont les partenaires avec lesquels le LRP interagit directement.
Grâce à des expériences de coimmunoprécipitation, nous avons pu montrer dans les CMLV humaines, après stimulation par l’IGF-1, la formation d’un complexe entre l’IGFR et le LRP. Ce résultat est également observé dans les MEF LRP+/+ et les MEF LRP-/- retransfectées par le domaine cytoplasmique du LRP-1 à la différence que ce complexe est déjà présent à l’état basal (figure 5).
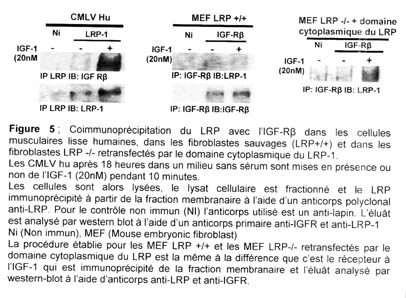
Le LRP et le récepteur à l’IGF-1 font donc partie d’un même zomplexe de signalisation.
Objectif 2 : Approche in vivo – Génération des souris ShcAflox/flox
- Construction du vecteur cible :
Nous avons achevé la construction du vecteur cible en mars 2006.
Technique utilisée : Les souris qui portent un gène ShcA dans lequel des sites LoxP ont été introduit sont générées par la technique du « gene targeting ». Les sites loxP sont introduits du coté 5’ en amont de l’exon 2 et du coté 3’ en aval de l’exon 8. Une cassette PGK-neo qui contient deux sites FRT est introduite en aval de l’exon 8. L’excision après action de la CRE recombinase permettra de supprimer un fragment d’environ 2 kb contenant la séquence qui code pour la moitié N terminale du domaine PTB.
Ainsi, toute protéine produite par le locus ciblé sera déficiente en un domaine PTB complet et donc ne possédera aucune activité de signalisation. - Injection des cellules ES :
L’injection du vecteur cible dans les cellules ES a été réalisée en mai 2006 avec la collaboration de la clinique de la souris de Strasbourg. - Criblage des clones positifs :
Après un premier criblage nous avons obtenu trois clones positifs ayant réalisé la recombinaison homologue. De ces trois clones seul un des clones a été validé par Southern-blot. - Injection d’un clone cellules ES en blastocyste :
A présent le clone positif va être injecté dans la cavité d’un blastocyste pour être ensuite réimplanté dans une mère porteuse.
L’obtention des souris homozygotes ShcA flox/flox est prévue pour le printemps 2007.
Conclusion – Poursuite du projet
Les résultats supplémentaires obtenus depuis l’année dernière sont très encourageants et font apparaître le complexe LRP-IGFR-ShcA comme un acteur nouveau et original du contrôle des voies de signalisation intracellulaire mises en jeu par un facteur de croissance impliqué dans le développement des lésions athéroscléreuses.
L’analyse phénotypique des souris déficientes en ShcA spécifiquement au niveau des cellules musculaires lisses ou des cellules endothéliales sera très utile pour caractériser in vivo le rôle joué par ShcA dans le développement des lésions athéroscléreuses. Ces 2 approches in vitro et in vivo sont complémentaires.
Perspectives : Objectif 1
Formation du complexe LRP/IGFR
Afin de déterminer si l’interaction entre le LRP et ShcA est la conséquence d’une interaction physique directe entre les 2 partenaires, nous allons poursuivre les expériences d’immunoprécipitation dans différents clones cellulaires (MEF LRP+/+, MEF exprimant uniquement le domaine extracellulaire du LRP-1, MEF exprimant uniquement le domaine intracellulaire du LRP-1) après stimulation par l’IGF-1.
Phosphorylation du LRP par IGF-1
La phosphorylation de la partie cytoplasmique du LRP a été décrite après stimulation dans les cellules par le PDGF. Afin de déterminer si l’IGF-1 a le même pouvoir, nous étudierons l’état de phosphorylation du domaine cytoplasmique du LRP qui constituerait un point d’ancrage potentiel pour ShcA (par immunoprécipitation et analyse par western-blot ou par marquage métabolique au P[32]).
Perspectives : Objectif 2
Caractérisation phénotypique des souris déficientes en ShcA au niveau des CMLV ou des cellules endothéliales (CE) :
L’inactivation de ShcA dans les CMLV sera réalisée en croisant les souris transgéniques SM22 Cre spécifique des CMLV (don de Dr Joachim Herz, UT Southwestern Medical Center, Dallas, Texas) avec les souris ShcAflox/flox. ShcA est également exprimé dans les CE, un autre constituant de la paroi vasculaire jouant un rôle important dans la formation des lésions athéroscléreuses. L’inactivation de ShcA dans les CE sera réalisée en croisant les souris transgéniques Tie2-Cre spécifique des CE (don de Dr M. Yanagisawa, UT Southwestern Medical Center, Dallas, Texas).
Dans le but d’augmenter la susceptibilité de ces souris à développer des lésions athéroscléreuses, nous les croiserons avec des souris déficientes en récepteur aux lipoproteines LDL (LDLr -/-) (déjà disponibles au laboratoire). Des animaux de 3-6 mois seront nourris par un régime riche en cholestérol pendant 6-8 semaines et analysés pour observer la formation des lésions athéroscléreuses.
L’analyse du phénotype de ces souris permettra de comprendre le rôle joué par ShcA in vivo dans le développement des lésions athéroscléreuses et de déterminer si les mécanismes mis en évidence pour le contrôle de la prolifération cellulaire in vitro sont également mis en jeu in vivo.
[1] Boucher P, Gotthardt M, Li WP, Anderson RG, Herz J. LRP : role in vascular wall integrity and protection from atherosclerosis. Science. 2003 ;300(5617):329-32.
[2] Boucher P, Liu P, Gotthardt M, Hiesberger T, Anderson RG, Herz J. Platelet-derived Growth Factor mediates tyrosine phosphorylation of the cytoplasmic domain of low density lipoprotein receptor-related protein in caveolae. J Biol Chem. 2002 ;277(18):15507-13.
[3] Ravichandran KS. Signaling via ShcA family adapter proteins. Oncogene. 2001 ;20(44):6322-30.
[4] Barnes H, Ackermann EJ, Van der geer P. v-src induces Shc binding to tyrosine 63 in the cytoplasmic domain of the LDL receptor-related protein1. Oncogene. 2003 ;22(23):3589-97.


