La Letttre de la NSFA, n°29, juin 07
Bertrand Perret, AC Fabre, A Genoux, C Malaval, C. Radojkovic, F Tercé, X Collet et LO Martinez INSERM U 563, Equipe Lipoprotéines, et CCBLA-nSFA, CHU-Toulouse
Le rôle protecteur des HDL vis-à-vis du risque cardiovasculaire a été documenté par un grand nombre d’études épidémiologiques et d’essais thérapeutiques. En France, le déficit isolé en HDL-C (<0,4 g/l) représente la deuxième dyslipidémie, avec une fréquence de 12% en population générale, alors que c’est l’anomalie la plus fréquente chez les patients coronariens. En outre, un niveau bas de HDL-C est retrouvé dans les situations d’hypertriglycéridémie, les deux éléments entrant dans la définition du syndrome dysmétabolique associé à un contexte d’insulinorésistance, qui concerne plus de 15% de la population française adulte.
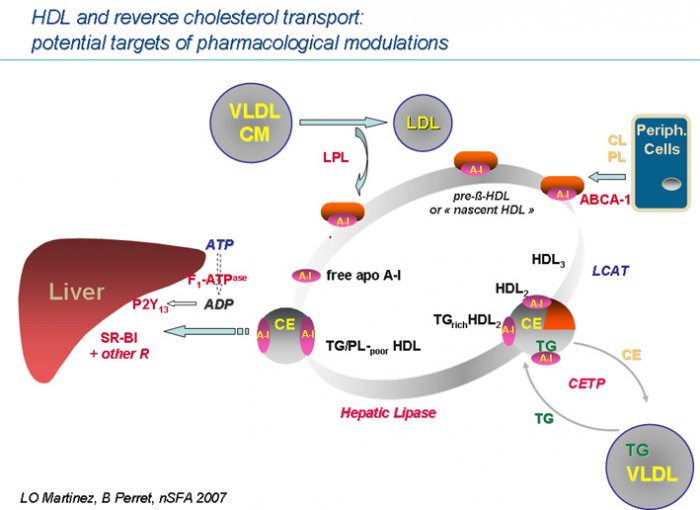
I am text block. Click edit button to change this text. Lorem ipsum dolor sit amet, consectetur adipiscing elit. Ut elit tellus, luctus nec ullamcorper mattis, pulvinar dapibus leo.Les mécanismes des effets athéroprotecteurs des HDL sont multiples. Ces particules véhiculent des enzymes capables de dégrader les phospholipides oxydés au sein des LDL. Par ailleurs, les HDL s’opposent aux effets biologiques des LDL-oxydées. Sur les cellules endothéliales, les HDL ont un effet anti-apoptotique, elles diminuent l’expression de molécules d’adhésion des monocytes (ICAM-1, VCAM-1) et du facteur antifibrinolytique PAI-1, mais stimulent la synthèse de molécules vasodilatatrices, oxyde nitrique et PGI2. Cependant, l’effet athéroprotecteur des HDL est principalement attribué à leur rôle dans le transport-retour du cholestérol (TRC), c’est-à-dire à leur capacité à capter le cholestérol des cellules périphériques, macrophages et cellules spumeuses notamment, pour l’emmener au foie et stimuler la sécrétion de stérols biliaires. Cette fonction est sous-tendue à la fois par les interactions cellulaires des HDL et par leur remodelage dans le compartiment plasmatique [1].
L’hépatocyte et l’entérocyte synthétisent l’apo A-I, exportée sous forme de HDL « naissantes ». Celles-ci sont des particules discoïdales de petite taille, comportant quelques molécules de phospholipides (PL), de cholestérol et des apolipoprotéines. Leur enrichissement en lipides en provenance des cellules est gouverné par le transporteur ABCA1, volumineuse protéine transmembranaire liant et hydrolysant l’ATP. ABCA1 promeut le transport du cholestérol depuis le réticulum endoplasmique vers la membrane plasmique et sa translocation vers le feuillet externe, où il devient accessible aux HDL « naissantes ». L’importance d’ABCA1 dans la genèse des HDL est bien illustrée par la maladie de Tangier, déficit homozygote en ABCA1 associant une quasi-absence de HDL et une surcharge en cholestérol des territoires macrophagiques. La maturation intra-plasmatique des HDL fait ensuite appel à la lécithine cholestérol acyl-transférase (LCAT) qui estérifie le cholestérol au sein des HDL, les transformant en particules sphériques de volume progressivement croissant. La protéine de transfert du cholestérol estérifié (CETP) agit en relais, en redistribuant les molécules de cholesterol ester (CE) formées dans les HDL, principalement vers les LDL, ce qui permet un retour du cholestérol au foie par l’intermédiaire des récepteurs apo B/E hépatiques. En situation de normolipémie, cette voie « indirecte », via les LDL, est un contributeur efficace du TRC. Par contre, au cours des hypertriglycéridémies, le transfert du CE à partir des HDL est stimulé et détourné au profit des VLDL. Les HDL perdent leur contenu en CE et s’enrichissent en triglycérides (TG), alors que les lipoprotéines riches en TG s’enrichissent CE, générant des remnants au catabolisme ralenti.
Les dernières étapes du TRC
Les mécanismes de captation hépatique des HDL ont fait l’objet d’avancées récentes. Un événement préliminaire est représenté par l’hydrolyse des TG et PL des HDL matures, par la triglycéride lipase des capillaires hépatiques (TGL-H). La TGL-H a parfois été proposée comme un acteur « pro-athérogène », du fait que son activation conduit à une accélération du catabolisme des HDL et à une réduction de leurs taux plasmatiques, ainsi qu’à la formation de petites LDL athérogènes. Cependant, l’exploration de variants fonctionnels de TGL-H sur des cohortes de patients a montré qu’une activité réduite de la TGL-H conférait un risque accru de coronaropathie [2]. En fait, la TGL-H a un double impact sur la dynamique des particules-HDL : elle génère des HDL pauvres en PL et TG, qui sont efficacement captées par les hépatocytes et elle permet aussi la libération, à partir de la surface des HDL, d’apo A-I libre qui conduira à la reformation de HDL « naissantes ». La découverte, en 1996, du récepteur « scavenger » SR-B1 à la surface des hépatocytes a fourni une base moléculaire aux mécanismes de captation du cholestérol par le foie et les organes stéroïdogènes. Dans les modèles murins, les variations pharmacologiques ou génétiquement induites de SR-B1 hépatique s’accompagnent de variations similaires de la captation hépatique de HDL-C et de la sécrétion de stérols biliaires, et de variations opposées des taux de HDL. Par ailleurs, les animaux présentant une surexpression modérée de SR-B1 développent moins de lésions d’athérosclérose. SR-B1 faciliterait sélectivement le transfert de CE des HDL vers les cellules, en formant un canal hydrophobe. Cependant, l’importance sur le métabolisme des HDL de l’homologue humain de SR-B1, le récepteur CLA-1, est beaucoup moins établie. Par exemple, les variants géniques de CLA-1 ont des impacts modestes sur le profil lipoprotéique, parfois plus prononcés sur les taux de LDL, qui, chez l’homme, pourraient être des agonistes plus efficaces de SR-B1. La problématique de la captation hépatique des HDL a rebondi avec la découverte récente d’un récepteur de haute affinité pour l’apo A-I. Des observations ont montré que l’apo A-I libre, formée notamment sous l’action de la TGL-H, stimulait la captation de la particule-HDL entière par des hépatocytes humains. Le récepteur spécifique de l’apo A-I a été ensuite isolé et trouvé identique au complexe F1 de l’ATP-synthase mitochondriale. Dans cette situation ectopique, sur la membrane plasmique, le complexe F1 hydrolyse l’ATP produisant de l’ADP extra-cellulaire, qui interagit secondairement avec P2Y13, un récepteur purinergique récemment découvert à la surface des hépatocytes. L’activation de P2Y13 résulte finalement en une stimulation de l’endocytose des HDL, via des récepteurs de basse affinité, auxquels contribue pour partie SR-B1 [1] [3] [4].
I am text block. Click edit button to change this text. Lorem ipsum dolor sit amet, consectetur adipiscing elit. Ut elit tellus, luctus nec ullamcorper mattis, pulvinar dapibus leo.Ce survol rapide des mécanismes connus du métabolisme des HDL permet de dégager des cibles potentielles en vue de stimuler le TRC. Tout d’abord, au vu des relations inverses que nous avons rappelées, une réduction efficace de la triglycéridémie doit conduire à des effets positifs sur le HDL-C. On sait depuis longtemps que l’acide nicotinique inhibe la lipolyse des TG du tissu adipeux par la lipase hormono-sensible, réduisant les taux intraplasmatiques des acides gras libres (AGL), et leur réestérification sous forme de TG dans l’hépatocyte. La diminution des AGL a également des effets positifs sur la correction de l’insulinorésistance au niveau musculaire. La découverte de récepteurs membranaires à l’acide nicotinique, couplés à la protéine Gi, très exprimés sur les adipocytes, éclaire les mécanismes d’action de cet hypolipémiant [1]. D’autres travaux ont évoqué un effet de l’acide nicotinique ralentissant la captation hépatique des HDL, mais les mécanismes impliqués sont loin d’être élucidés. Quoi qu’il en soit, la niacine est aujourd’hui l’agent pharmacologique induisant les augmentations les plus franches du HDL-C, associées à une réduction des TG, et des études en prévention secondaire, en monothérapie ou en association aux statines, ont documenté son rôle bénéfique sur la réduction du risque cardiovasculaire. Les fibrates réduisent la triglycéridémie par différents mécanismes : en stimulant l’oxydation des acides gras hépatocytaires au détriment de la synthèse de TG, et en favorisant l’expression de la lipoprotéine lipase (LPL). La LPL est impliquée dans l’hydrolyse des TG au sein des VLDL et des chylomicrons, mais les remodelages induits de ces lipoprotéines génèrent des fragments de surface qui constituent également une source de HDL « naissantes ». Enfin, les fibrates stimulent l’expression d’ABCA1 dans les cellules périphériques et d’apo A-I hépatique, contribuant là aussi à la synthèse des HDL [1,3]. Ces deux exemples illustrent bien la difficulté de distinguer les effets propres sur le système HDL, d’effets sur la correction de la triglycéridémie et de l’insulinorésistance. Plusieurs essais ont été menés utilisant des inhibiteurs de CETP avec la perspective de limiter les transferts de HDL-C en direction des autres lipoprotéines. Ces études ont démontré des effets spectaculaires sur les taux de HDL-C (+ 60%), associées à des réductions modestes du LDL-C. Toutefois, ces molécules n’ont pas jusqu’ici montré d’effet positif sur l’athérosclérose coronarienne, mais un effet délétère sur la pression artérielle et, finalement, un surcroît de mortalité conduisant à l’arrêt du développement de la plus avancée d’entre elles [5]. Dans le principe, d’ailleurs, on peut s’interroger sur l’opportunité qu’il y aurait, chez des patients normotriglycéridémiques, à bloquer la voie « indirecte » CETP-dépendante du TRC. Dans cette perspective, la séquence F1-ATPase/P2Y13 pourrait constituer une cible d’avenir, dont la stimulation devrait logiquement conduire à favoriser les dernières étapes de la voie « directe » du TRC, via la captation des HDL.
De manière générale, les nouvelles stratégies contre l’athérosclérose basées sur le « système-HDL » viseront peut-être d’avantage à stimuler les fonctions de ces lipoprotéines qu’à simplement augmenter leurs taux plasmatiques.