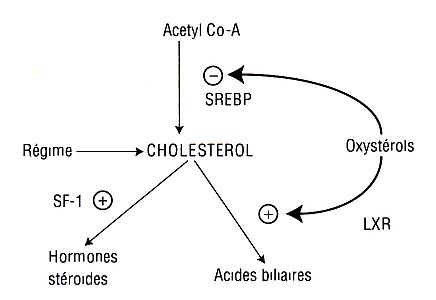
Le régime influence le développement des maladies cardiovasculaires et les études épidémiologiques révèlent que la prévalence de ces maladies varient beaucoup selon les pays, donc selon les habitudes alimentaires [1]. Dans ce contexte les facteurs, spécifiques qui interviennent dans l’athérosclérose ont été activement recherchés et deux constituants nutrritionnels, cholestérol et acides gras saturés, ont été rendus responsables du développement de cette pathologie [2]. En effet, ces deux constituants agissent en augmentant les niveaux circulants de lipoprotéines de basse densité (LDL), une des classes de lipoprotéines les plus athérogènes [3].
L’effet de régimes isocaloriques riches en sucres ou en lipides sur la synthèse du cholestérol et l’expression des gènes clefs du métabolisme du cholestérol a récemment été exploré chez les sujets sains [2]. Le régime riche en carbohydrates abaisse le cholestérol total, le LDL cholestérol et le HDL cholestérol sans modifier le rapport LDL/HDL ; la concentration des triglycérides reste inchangée. Ces modifications interviennent en dépit d’une synthèse élevée de cholestérol et d’une expression accrue de l’ARNm de la HMG CoA réductase, enzyme clé de la biosynthèse du cholestérol ; le niveau d’expression du LDL récepteur est inchangée et la tolérance au glucose est meilleure [2]. Lorsque l’apport du cholestérol exogène est faible ou nul, la diminutiondu cholestérol total circulant du cholestérol circulant total est plus difficile à expliquer. Une des hypothèses repose sur le métabolisme accru et le mouvement du cholestérol à partir des VLDL.
Les études épidémiologiques ont montré depuis longtemps la relation positive entre le niveau de cholestérol plasmatique et les maladies cardiovasculaires. Les interventions nutritionnelles, en réduisant le cholestérol ou les acides gras absorbés, ont pour effet d’abaisser le cholestérol plasmatique et montrent ainsi une protection relative. Le niveau de mortalité par maladies cardiovasculaires et le niveau moyen du cholestérol plasmatique varient selon les populations. D’après l’étude des sept pays d’Ancel Keys [3], des différences ont été observées entre le nord et le sud de l’Europe et le régime méditerranéen a montré un effet protecteur. Il se caractérise par une consommation basse de lipides saturés et une consommation élevée de graisses insaturées, de sucres complexes et de fibres, liés respectivement à un apport journalier d’huile d’olive, de céréales, de fruits et de légumes.